Les réseaux d’actine branchés dépendent d’une collaboration entre machines moléculaires
Les réseaux d’actine branchés sont polymérisés par le complexe Arp2/3 qui nécessite un filament préexistant pour nucléer un nouveau filament. Un tout premier filament est donc critique pour déclencher la réaction. Une étude, impliquant notamment des chercheurs du Laboratoire de Biologie Structurale de la Cellule - BIOC (CNRS/Ecole Polytechnique) et de l'Institut de Biologie Intégrative de la Cellule - I2BC (CNRS/CEA/Univ. Paris-Saclay), publiée dans la revue Science Advances, révèle que ce premier filament provient des protéines apparentées à l’actine du complexe Dynactine, dont la fonction était jusque là inconnue. "Qui se ressemble s’assemble"!
La polymérisation de réseaux d’actine branchés développe une force de poussée. Cette poussée permet la protrusion de la membrane dans la migration cellulaire ou la scission d’intermédiaires de transport dans le trafic intracellulaire, en étranglant littéralement le cou des vésicules. Le complexe Arp2/3 est l’unique machine moléculaire qui polymérise l’actine de manière branchée. Pour cela, cette machine contient deux protéines apparentées à l’actine, Arp2 et Arp3, (Arp : Actin-related protein) qui nucléent un nouveau filament d’actine quand Arp2/3 se pose sur un filament préexistant. Différents activateurs du complexe Arp2/3 ont des fonctions distinctes. Par exemple, le complexe WAVE reconnaît la membrane externe des cellules et déclenche une structure de migration alors que le complexe WASH reconnaît des structures membranaires internes, appelées endosomes. Le complexe WASH possède une particularité surprenante par rapport à WAVE: il déclenche la polymérisation d’actine branchée par Arp2/3 et recrute aussi la protéine de coiffe, qui termine l’élongation des filaments d’actine. Pourquoi le complexe WASH recrute-t-il deux activités antagonistes ?
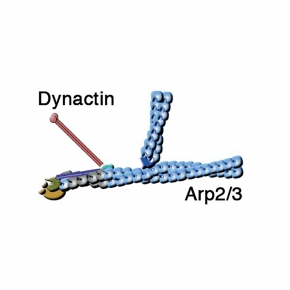
Les endosomes trient les récepteurs internalisés grâce à des moteurs moléculaires, qui « marchent » le long de microtubules, véritables autoroutes de la cellule. Le complexe Dynactine relie ces moteurs à la membrane des endosomes et permet aux moteurs de tirer des tubes de membrane. Le complexe Dynactine contient lui aussi la protéine de coiffe. Cette coiffe recouvre un filament composé de protéines apparentées à l’actine, le « minifilament Arp1/11 ». Depuis la découverte de Dynactine, il y a 30 ans, cette observation intrigue les chercheurs : pourquoi la Dynactine, ce régulateur des moteurs microtubulaires, est-elle organisée autour d’un minifilament de protéines apparentées à l’actine ?
La croissance d’un réseau d’actine branchée est qualifiée d’ « autocatalytique », parce que le nouveau filament initié par branchement d’un filament préexistant peut à son tour servir de substrat à un nouveau branchement. Un réseau extrêmement dense peut donc croître très rapidement pourvu qu’un premier filament soit présent. La membrane externe des cellules repose sur des filaments d’actine, donc il n’y a pas de problème pour induire une structure de migration. Mais pour un endosome, d’où provient le premier filament initiant le réseau d’actine branché aboutissant à la scission de la vésicule contenant les récepteurs triés ?
Dans cette étude, les scientifiques valident un scénario moléculaire original qui répond d’un seul coup aux trois questions posées: Le complexe WASH « décoiffe » le minifilament Arp1/11 de la Dynactine, qui est ensuite allongé par de l’actine. Ce premier filament déclenche la réaction de branchement Arp2/3, elle aussi contrôlée par WASH. Dans le cadre d'une collaboration avec le Medical Research Council à Cambridge au Royaume-Uni, les chercheurs ont réussi à reconstituer ce mécanisme dans le tube à essai avec 3 machines moléculaires purifiées.
Le complexe WASH coordonne donc deux machines moléculaires contenant des protéines apparentées à l’actine pour induire le réseau d’actine branchée. Lorsque WASH n’est plus en mesure de décoiffer la Dynactine, les cellules migrent de manière aberrante et ne peuvent plus capter le glucose extérieur, parce les récepteurs d’adhérence et les transporteurs du glucose ne sont plus recyclés par manque de scission des vésicules endosomales. Ces observations illustrent l’importance de ce mécanisme de polymérisation d’actine et la coordination subtile des différents éléments du squelette de la cellule qui poussent et tirent sur les membranes pour les remodeler de manière dynamique.
Les réseaux d’actine branchés dépendent d’une collaboration entre machines moléculaires
Un modèle de coordination des complexes Dynactine et Arp2/3 par le complexe WASH. L’animation commence après 2 secondes de présentation de Dynactine. © Alexis Gautreau
Audiodescription
Pour en savoir plus :
The Arp1/11 Minifilament of Dynactin primes the Endosomal Arp2/3 Complex
Fokin AI, David V, Oguievetskaia K, Derivery E, Stone C, Cao L, Rocques N, Molinie N, Henriot V, Aumont-Nicaise M, Hinckelmann MV, Saudou F, Le Clainche C, Carter AP, Romet-Lemonne G, Gautreau AM.
Science Advances 13 Janvier 2021. DOI: 10.1126/sciadv.abd5956
Contact
Alexis Gautreau, Directeur de Recherche CNRS au Laboratoire de Biologie Structurale de la Cellule - BIOC (CNRS/Ecole Polytechnique)